Nhận Biết và Xử Trí Tím Tái ở Trẻ Sơ Sinh Bị Bệnh Tim Bẩm Sinh (TBS)
Tím tái là một triệu chứng đáng báo động ở trẻ sơ sinh, đặc biệt khi liên quan đến bệnh tim bẩm sinh (TBS). Theo thống kê, khoảng 1/3 các dạng TBS có thể gây tím tái, và đây là một trong những nguyên nhân hàng đầu gây tử vong ở trẻ sơ sinh. Do đó, việc nhận biết sớm các dấu hiệu tím tái, thực hiện cấp cứu ban đầu và nhanh chóng chuyển trẻ đến các trung tâm chăm sóc tim mạch chuyên sâu là vô cùng quan trọng để tăng cơ hội sống sót cho trẻ.
1. Chẩn đoán trước sinh
- Siêu âm tim thai:
- Siêu âm trước sinh đóng vai trò quan trọng trong việc phát hiện các dị dạng cấu trúc, bao gồm cả bệnh tim bẩm sinh (TBS). Ngoài ra, siêu âm cũng có thể phát hiện các bất thường khác như thoát vị hoành và dị dạng u tuyến bẩm sinh dạng nang. Tuy nhiên, cần lưu ý rằng độ nhạy của siêu âm trong việc phát hiện TBS có thể thay đổi đáng kể, phụ thuộc vào trình độ chuyên môn của người thực hiện, tuổi thai, vị trí của thai nhi và loại khuyết tật tim cụ thể. Do những hạn chế này, siêu âm trước sinh có thể bỏ sót một số trường hợp TBS gây tím tái.
- Để tăng khả năng phát hiện TBS trước sinh, việc thực hiện siêu âm tim thai chuyên sâu bởi các chuyên gia được đào tạo chuyên về tim mạch thai nhi là rất cần thiết. Siêu âm tim thai không chỉ là siêu âm sản khoa thông thường mà cần được thực hiện bởi người có kinh nghiệm và kiến thức chuyên sâu về tim thai. Tham khảo: Donofrio MT, Moon-Grady AJ, Hornberger LK, et al. Diagnosis and treatment of fetal cardiac disease: a scientific statement from the American Heart Association. Circulation 2014; 129:2183.
2. Chẩn đoán sau sinh
- Các bước chẩn đoán:
- Ở những trẻ sơ sinh không được chẩn đoán TBS trước sinh, việc nghi ngờ bệnh có thể dựa trên tiền sử bệnh, kết quả khám lâm sàng, sàng lọc bằng đo SpO2, chụp X-quang ngực và/hoặc điện tâm đồ (ECG). * Chẩn đoán xác định TBS được thực hiện bằng siêu âm tim. * Trong một số cơ sở y tế không có sẵn siêu âm tim nhi, thử nghiệm thở oxy nồng độ cao có thể được sử dụng để phân biệt TBS với các nguyên nhân hô hấp gây tím.* Nguyên nhân tím tái:
- Chứng xanh tím trung ương xảy ra do giảm độ bão hòa oxy trong máu động mạch, thường có thể nhận biết được khi nồng độ hemoglobin giảm quá 3 g/dL. Tình trạng này có thể do nhiều cơ chế bệnh lý khác nhau, bao gồm rối loạn tim mạch, bất thường ở phổi hoặc bệnh lý về huyết sắc tố.* Phân biệt các dạng TBS:
- Khám sức khỏe toàn diện, chụp X-quang phổi và điện tâm đồ có thể giúp phân biệt các dạng TBS tím phổ biến với nhau và với các nguyên nhân khác gây tím trung ương. Siêu âm tim giúp xác định chẩn đoán, đánh giá giải phẫu và chức năng cơ bản của tim.
2.1. Tiền sử
- Yếu tố nguy cơ:
- Cần khai thác tiền sử bệnh lý hoặc các vấn đề sản khoa của người mẹ, cũng như tiền sử gia đình có người mắc TBS, vì những yếu tố này làm tăng nguy cơ mắc TBS ở trẻ.
2.2. Khám lâm sàng
- Phân biệt TBS và các rối loạn khác:
- Khám lâm sàng đóng vai trò quan trọng trong việc phân biệt TBS với các rối loạn gây tím tái khác, chẳng hạn như bệnh hô hấp hoặc nhiễm trùng huyết. Sau khi xác định nguyên nhân gây tím là do bệnh tim, khám lâm sàng cũng cung cấp những manh mối quan trọng về các khuyết tật tim cụ thể.
2.3. Dấu hiệu sinh tồn
- Đo lường:
- Ở trẻ sơ sinh bị tím tái, các chỉ số sinh tồn như mạch, nhịp thở, độ bão hòa oxy và huyết áp (đo ở cả tay phải và một trong hai chân) có thể tương tự nhau giữa TBS và các nguyên nhân khác. Tuy nhiên, trong một số trường hợp, những phát hiện cụ thể có thể gợi ý một tổn thương tim nhất định.* Ý nghĩa:
- Sự chênh lệch huyết áp giữa tay và chân, hoặc mạch đùi yếu hoặc không có, có thể gợi ý rối loạn chức năng thất trái liên quan đến hẹp eo động mạch chủ nặng hoặc gián đoạn cung động mạch chủ. Tuy nhiên, nếu ống động mạch còn lớn, có thể không phát hiện được sự chênh lệch huyết áp giữa tay và chân trong những rối loạn này. * Suy hô hấp nặng, biểu hiện bằng thở nhanh, co rút và quấy khóc, thường cho thấy có vấn đề về hô hấp. Tuy nhiên, một số bệnh tim cấu trúc cũng có thể biểu hiện các triệu chứng tương tự. Ví dụ bao gồm kết nối tĩnh mạch phổi bất thường toàn bộ có tắc nghẽn và bệnh tắc nghẽn tim trái (ví dụ: hội chứng tim trái giảm sản [HLHS], hẹp van động mạch chủ nghiêm trọng và hẹp eo động mạch chủ nặng). Trẻ sơ sinh bị TBS tím thường biểu hiện tím tái kèm theo nhịp thở nhanh nhẹ hoặc không có. * Các dấu hiệu sinh tồn có thể bình thường ở một số trẻ bị tím tái do bệnh tim cấu trúc. Chúng cũng có thể bình thường trong bệnh đa hồng cầu, dị dạng động mạch phổi hoặc methemoglobin huyết. * Tím ngoại vi kết hợp với nhịp tim nhanh, thở nhanh và hạ huyết áp thường gợi ý nhiễm trùng huyết. Tuy nhiên, cũng cần xem xét các tổn thương tắc nghẽn tim trái gây suy tim như thiểu sản tim trái (HLHS), hẹp eo động mạch chủ nguy kịch và hẹp van động mạch chủ nặng để chẩn đoán phân biệt với tím ngoại vi.
2.4. Đo SpO2
- Vị trí đo:
- Ở trẻ sơ sinh tím tái, độ bão hòa oxy qua da (SpO2) nên được đo ở vị trí trước ống (tay phải) và sau ống (chân phải hoặc chân trái).* Ý nghĩa:
- Giá trị SpO2 giảm khi tím trung tâm và thường bình thường khi tím ngoại vi. Sự khác biệt về giá trị SpO2 ở hai vị trí này giúp xác định bệnh nhân bị tím khác nhau. Việc sử dụng thường quy phương pháp đo SpO2 trong thời kỳ sơ sinh để tầm soát bệnh TBS nghiêm trọng đã được chứng minh là có hiệu quả để xác định trẻ sơ sinh không được phát hiện trước khi sinh.
2.5. Tiếng tim thứ hai (S2)
- Bình thường:
- Tiếng tim thứ hai (S2) thường tách đôi ngẫu nhiên (thành phần động mạch chủ trước thành phần động mạch phổi). Khoảng 66% trẻ sơ sinh 16 giờ tuổi nghe thấy tiếng tách đôi này, và tỷ lệ này tăng lên 80% sau 48 giờ.* TBS tím:
- Trong các dạng TBS tím sau đây, mặc dù có thể khó đánh giá ở trẻ có nhịp tim nhanh hoặc trẻ ốm yếu, S2 dường như đơn độc mà không tách đôi khi nghe tim: * Trong chuyển vị đại động mạch, động mạch phổi nằm ở phía sau động mạch chủ. Do đó, thành phần động mạch chủ của S2 nghe to hơn do vị trí phía trước, còn thành phần động mạch phổi mềm hơn và thường không nghe được rõ. * Trong teo động mạch phổi còn ống động mạch hoặc HLHS với thiểu sản động mạch chủ, chỉ có một van bán nguyệt duy nhất, do đó S2 chỉ có một thành phần. * Trong tứ chứng Fallot (TOF), tiếng thổi van động mạch phổi giảm dần liên quan đến hẹp phổi làm cho thành phần động mạch phổi của S2 mềm và khó phát hiện, đặc biệt nếu có tiếng thổi tâm thu đường ra thất phải. * S2 thường tách đôi ở những bệnh nhân bị dị tật van ba lá do Ebstein và tách đôi rộng ở những bệnh nhân có kết nối tĩnh mạch phổi bất thường toàn bộ, tuy nhiên điều này cũng khó đánh giá ở trẻ sơ sinh có nhịp tim nhanh.
2.6. Tiếng thổi
- Ý nghĩa:
- Tiếng thổi bệnh lý có thể nghe được ở hầu hết các dạng TBS tím thường gặp. * Bệnh nhân TOF thường có tiếng thổi do hẹp phổi. TOF liên quan đến mất trương lực phổi thường có tiếng thổi liên quan đến ống động mạch (PDA) hoặc động mạch phổi hẹp có thể được phát hiện khi sức cản mạch máu phổi giảm. * Nghe thấy tiếng thổi tâm thu mềm ra trong trường hợp teo phổi có vách liên thất còn nguyên vẹn, HLHS hoặc thân chung động mạch. Trong tất cả các tổn thương này, cung lượng tim đi qua một van bán nguyệt duy nhất và thể tích dòng máu gây ra tiếng thổi liên quan. Một số bệnh nhân còn thân chung động mạch cũng có tiếng thổi tâm trương do hở van hai lá. * Tình trạng teo phổi thường đi kèm với hở van ba lá, tạo ra một tiếng thổi tâm thu ở bờ dưới xương ức bên trái. * Chứng thiểu sản van ba lá thường liên quan đến thông liên thất và hẹp động mạch phổi, tạo ra các tiếng thổi tâm thu. * Hở van ba lá trong bất thường Ebstein gần như luôn luôn tạo ra tiếng thổi tâm thu ở bờ dưới xương ức trái. * Chuyển vị đại động mạch (D-TGA) với vách liên thất nguyên vẹn và không có hẹp phổi thường không có tiếng thổi.
2.7. Gan to
- Ý nghĩa:
- Gan to thường xảy ra ở bệnh nhân suy tim do tổn thương tắc nghẽn bên trái (ví dụ: HLHS, hẹp eo động mạch chủ, hẹp van động mạch chủ nguy kịch và bệnh cơ tim) hoặc kết nối tĩnh mạch phổi bất thường toàn phần dưới hoành. Gan sờ thấy ở đường giữa gợi ý TBS phức tạp (hội chứng heterotaxy) liên quan đến chứng đa lách hoặc vô lách. * Một số trẻ sơ sinh bị bệnh phổi có thể có biểu hiện gan to, nhưng nguyên nhân là do cơ hoành dẹt bị dịch chuyển do phồng lên. Gan không to thực sự ở những bệnh nhân này.
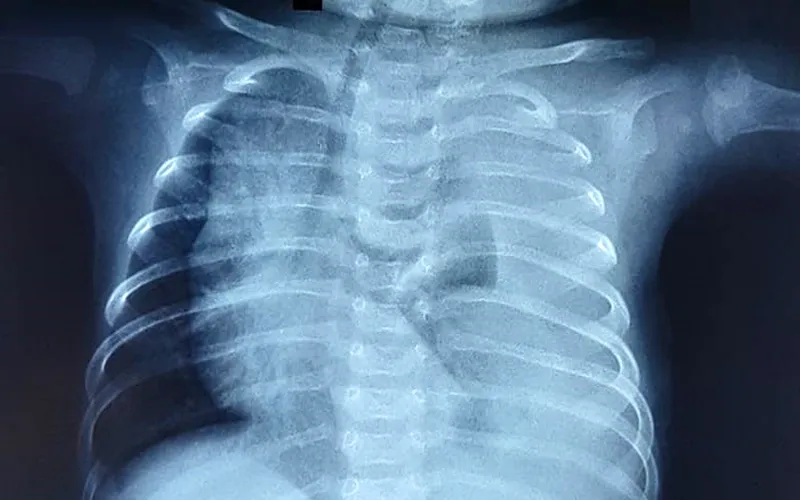
2.8. X-quang phổi
- Vai trò:
- X-quang phổi là một công cụ hữu ích trong việc phân biệt giữa các rối loạn tim và phổi. Việc kiểm tra các trường phổi giúp xác định các nguyên nhân phổi chính gây tím tái, bao gồm tràn khí màng phổi, giảm sản phổi, thoát vị cơ hoành, phù phổi, tràn dịch màng phổi hoặc bệnh đường thở.* Các đặc điểm gợi ý tổn thương tim:
- Ba đặc điểm của phim X-quang ngực có thể gợi ý các tổn thương tim cụ thể là kích thước hoặc hình dạng tim, dấu hiệu mạch máu phổi và vị trí của cung động mạch chủ. * Kích thước hoặc hình dạng trái tim: * Kích thước tim: Bệnh nhân có tổn thương tắc nghẽn bên trái có thể bị tim to do suy tim. Tim cực to gợi ý các tổn thương liên quan đến tâm nhĩ phải giãn vì buồng này rất phù hợp. Chúng bao gồm teo động mạch phổi với vách liên thất còn nguyên vẹn hoặc bất thường Ebstein. * Hình dạng tim: Các bất thường đặc trưng của hình dạng tim có liên quan đến các tổn thương cụ thể: * TOF - Tim hình chiếc ủng (coeur en sabot). * D-TGA - Hình trứng trên một chuỗi gây ra bởi bóng trung thất hẹp tạo ra bởi mối quan hệ trước-sau chứ không phải trái của các động mạch lớn. * Dấu hiệu mạch máu phổi: Hình thái dòng máu phổi phụ thuộc vào tổn thương tim cụ thể. Mặc dù dấu hiệu mạch máu phổi giảm xảy ra ở hầu hết các tổn thương TBS tím, chúng tăng lên ở những bệnh nhân thân chung động mạch hoặc các tổn thương hỗn hợp, chẳng hạn như kênh nhĩ thất thông thường, do sức cản mạch máu phổi giảm sau khi sinh. * Trong D-TGA, các dấu mạch máu có thể không đối xứng. Trong tình trạng này, các nhánh động mạch phổi phải từ động mạch phổi chính dọc theo trục dài của tâm thất trái, trong khi các nhánh động mạch phổi trái theo chiều dọc. Giải phẫu này thường thúc đẩy tăng lưu lượng ưu tiên đến phổi phải và lưu lượng máu không đối xứng với giảm đánh dấu ở phổi trái. * Tình trạng tắc nghẽn tĩnh mạch phổi do suy tim được đặc trưng bởi các dấu mạch không rõ ràng lan rộng theo hình bướm từ vùng trung tâm của lồng ngực. Điều này thường thấy trong kết nối tĩnh mạch phổi bất thường toàn bộ bị tắc nghẽn hoặc suy tim do tổn thương tắc nghẽn bên trái (HLHS hoặc coarctation nặng của động mạch chủ) hoặc bệnh cơ tim. * Vị trí của cung động mạch chủ: Vị trí của cung động mạch chủ được xác định bởi phế quản gốc nào mà cung bắt chéo. Điều này được xác định tốt nhất bằng sự thụt vào của khí quản trên hình ảnh phía trước, cho thấy phía mà cung động mạch chủ đang uốn cong. Giải phẫu bình thường là cung động mạch chủ bên trái với sự thụt vào của khí quản bên trái khi cung bắt chéo qua phế quản thân trái. * Cung động mạch chủ bên phải dẫn đến một vết lõm ở bên phải của khí quản. Khoảng 20% bệnh nhân TOF và 30% bệnh nhân thân chung động mạch có cung động mạch chủ bên phải. Bởi vì TOF phổ biến hơn nhiều so với thân chung động mạch, một cung động mạch chủ bên phải ở trẻ sơ sinh tím thường gợi ý TOF. Cung động mạch chủ bên phải cũng có thể kết hợp với các tổn thương khác, chẳng hạn như chuyển vị của các động mạch lớn.
2.9. Điện tâm đồ (ECG)
- Bình thường:
- Ở bào thai, tâm thất phải chịu tải thể tích lớn hơn tâm thất trái do lưu lượng phổi bị hạn chế và do đó thể tích máu ở tim trái giảm. Kết quả là ECG của trẻ sơ sinh bình thường lệch trục phải (trục QRS +90 đến +180 độ) và hình thái phì đại thất phải trước tim.* TBS:
- Mặc dù điện tâm đồ có thể bình thường trong nhiều tổn thương tim tím trong thời kỳ sơ sinh, một số tổn thương có liên quan đến các mô hình cụ thể. Chúng bao gồm: * Các tổn thương liên quan đến tâm thất phải nhỏ có những đặc điểm sau: * Độ lệch trục trái theo tuổi (đối với tình trạng không còn nguyên vẹn ở phổi, vách liên thất thường +30 đến +90 độ; đối với thiểu sản van ba lá với các động mạch lớn liên quan bình thường, thường là -30 đến -90 độ) * Giãn nhĩ phải - Sóng P cao, đỉnh dễ xác định nhất ở đạo trình II * Phì đại tâm thất trái * HLHS thường có phì đại thất phải rõ rệt (tăng điện thế QRS ở đạo trình phải và trước) và giảm lực thất trái ở các đạo trình trước tim bên. * Bất thường Ebstein có hiện tượng giãn nhĩ phải và thỉnh thoảng có một sóng delta của hội chứng Wolff-Parkinson-White.
2.10. Thử nghiệm tăng oxy máu
- Mục đích:
- Xét nghiệm tăng oxy máu trước đây được sử dụng để giúp phân biệt chứng tím do tim với phổi. Tuy nhiên, với sự ra đời của phương pháp kiểm tra SpO2 định kỳ để tìm TBS quan trọng và khả năng tiếp cận siêu âm tim được cải thiện, xét nghiệm tăng oxy máu thường không cần thiết.* Thực hiện:
- Tuy nhiên, xét nghiệm tăng oxy máu có thể hữu ích trong một số cơ sở, đặc biệt nếu không có sẵn siêu âm tim.* Ý nghĩa:
- Cơ sở sinh lý cho xét nghiệm tăng oxy máu như sau: * Trong TBS liên quan đến luồng thông trong tim từ phải sang trái dẫn đến tím, máu trong tĩnh mạch phổi được bão hòa hoàn toàn với oxy trong không khí xung quanh. Việc sử dụng nồng độ oxy cao hơn sẽ làm tăng lượng oxy hòa tan nhưng chỉ có tác động tối thiểu đến mức độ căng oxy vì sẽ không có tác động đến máu đã khử oxy được cung cấp cho hệ tuần hoàn. * Ngược lại, bệnh nhân bệnh phổi có hiện tượng khử bão hòa tĩnh mạch phổi. Sử dụng oxy bổ sung trong bệnh phổi thường làm tăng nồng độ oxy trong tĩnh mạch phổi và cải thiện oxy toàn thân. * Thử nghiệm tăng oxy được thực hiện bằng cách đo áp suất riêng phần của oxy (PaO2) trong động mạch cánh tay bên phải (trước ống) trước và sau khi bệnh nhân thở với nồng độ oxy 100% trong 10 phút. Sự gia tăng PaO2 đến mức > 150 mmHg trong quá trình thử nghiệm tăng oxy máu gợi ý bệnh phổi. Mức độ tăng ít hơn hoặc không tăng PaO2 trong quá trình thử nghiệm tăng oxy máu là dấu hiệu của TBS có tím. Mức độ PaO2 có phần khác nhau tùy thuộc vào loại tổn thương TBS.* Lưu ý: * Thử nghiệm tăng oxy không phải là xác định, và siêu âm tim là cần thiết để chẩn đoán TBS. * Bệnh nhân bị các dạng bệnh phổi nặng hoặc tăng áp động mạch phổi dai dẳng có thể không tăng đáng kể độ bão hòa oxy và PaO2 với thử thách tăng oxy máu. * Đáp ứng tăng oxy có thể được đánh giá một cách không chính thức bằng máy đo SpO2, do đó tránh chọc động mạch để lấy mẫu máu. Tuy nhiên, phương pháp này kém tin cậy hơn so với đo PaO2. Sự cải thiện độ bão hòa oxy ≥ 10% khi sử dụng 100% oxy cho thấy nguyên nhân tím ở phổi. Bản thân phát hiện này thường không đủ để bỏ qua đánh giá bổ sung bằng siêu âm tim. Tuy nhiên, nó có thể hữu ích khi được thêm vào các phát hiện khác gợi ý bệnh phổi (ví dụ: tiền sử, khám và các phát hiện trên X-quang phổi). Một phản ứng bất thường hoặc tương đương thường cần được đánh giá thêm (ví dụ: với siêu âm tim).
2.11. Siêu âm tim
- Vai trò:
- Siêu âm tim, bao gồm hình ảnh, Doppler xung và Doppler màu để đánh giá các mẫu dòng chảy, cung cấp một chẩn đoán xác định về TBS, đồng thời cung cấp thông tin chi tiết về giải phẫu và chức năng tim.* Chỉ định:
- Siêu âm tim nên được thực hiện ở trẻ sơ sinh bị tím trung tâm nếu đánh giá ban đầu không cho thấy một nguyên nhân rõ ràng nào khác gây ra mức oxy thấp (ví dụ: bệnh phổi). Các chỉ định khác cho siêu âm tim bao gồm huyết áp hoặc chênh lệch mạch giữa chi trên và chi dưới, tim to hoặc tiếng thổi bệnh lý.
2.12. Các xét nghiệm khác
- Khí máu động mạch:
- Phép đo khí máu động mạch cung cấp thông tin về PaO2, áp suất riêng phần của carbon dioxide trong động mạch (PaCO2; dấu hiệu của thông khí đầy đủ) và pH động mạch. * Giá trị PaO2 động mạch cung cấp dữ liệu cụ thể hơn so với độ bão hòa oxy. Do ái lực của hemoglobin bào thai tăng lên đối với oxy, giá trị PaO2 động mạch ở một mức độ bão hòa oxy nhất định thường thấp hơn ở trẻ sơ sinh so với người lớn. * Giá trị PaCO2 động mạch tăng cao thường cho thấy có bệnh phổi. PaCO2 động mạch cũng có thể tăng trong suy tim do tắc nghẽn phổi. * Mức độ pH giảm làm gia tăng lo ngại về cung lượng tim kém và tình trạng sốc đang chờ xử lý, có thể gặp trong trường hợp giảm oxy máu nặng và/hoặc suy tim. * Bệnh nhân methemoglobin huyết thường có độ bão hòa oxy thấp và độ căng oxy bình thường. Trong tình trạng không phổ biến này, máu có màu nâu sô cô la và không bị đỏ khi tiếp xúc với không khí.* Công thức máu toàn bộ:
- Trẻ sơ sinh bị tím nên được xét nghiệm công thức máu đầy đủ và phân tích phân biệt, điều này có thể giúp phân biệt TBS với các rối loạn không do tim. Ví dụ, nồng độ hematocrit hoặc hemoglobin tăng cao xác định bệnh nhân bị đa hồng cầu, trong khi số lượng bạch cầu tăng hoặc giảm hoặc giảm tiểu cầu cho thấy có thể nhiễm trùng huyết.* Đánh giá nhiễm trùng huyết:
- Vì nhiễm trùng huyết là một rối loạn thường gặp trong chẩn đoán phân biệt với TBS tím tái, nên cấy máu. Cũng thường phân tích nước tiểu và cấy nước tiểu. Tùy thuộc vào mức độ nghi ngờ lâm sàng, chọc dò thắt lưng nên được thực hiện với phân tích và nuôi cấy dịch não tủy. Kháng sinh theo kinh nghiệm thường được dùng cho đến khi có kết quả nuôi cấy. Tham khảo: Duff DF, McNamara DG. History and physical examination of the cardiovascular system. In: The science and practice of pediatric cardiology, Garson A Jr, Bricker TM, Fisher DJ, Neish SR (Eds), Williams and Wilkins, Baltimore 1998. p.693. Tham khảo: Report of the New England Regional Infant Cardiac Program. Pediatrics 1980; 65:375. Tham khảo: Akkinapally S, Hundalani SG, Kulkarni M, et al. Prostaglandin E1 for maintaining ductal patency in neonates with ductal-dependent cardiac lesions. Cochrane Database Syst Rev 2018; 2:CD011417. Tham khảo: Lewis AB, Freed MD, Heymann MA, et al. Side effects of therapy with prostaglandin E1 in infants with critical congenital heart disease. Circulation 1981; 64:893. Tham khảo: Giannone PJ, Luce WA, Nankervis CA, et al. Necrotizing enterocolitis in neonates with congenital heart disease. Life Sci 2008; 82:341. Tham khảo: Bubberman JM, van Zoonen A, Bruggink JLM, et al. Necrotizing Enterocolitis Associated with Congenital Heart Disease: a Different Entity? J Pediatr Surg 2019; 54:1755. Tham khảo: Day TG, Dionisio D, Zannino D, et al. Enteral feeding in duct-dependent congenital heart disease. J Neonatal Perinatal Med 2019; 12:9. Tham khảo: Willis L, Thureen P, Kaufman J, et al. Enteral feeding in prostaglandin-dependent neonates: is it a safe practice? J Pediatr 2008; 153:867. Tham khảo: Browning Carmo KA, Barr P, West M, et al. Transporting newborn infants with suspected duct dependent congenital heart disease on low-dose prostaglandin E1 without routine mechanical ventilation. Arch Dis Child Fetal Neonatal Ed 2007; 92:F117.